- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:48.
- Modificat ultima dată 2025-06-01 07:37.
Diferența cheie - Ligand puternic vs Ligand slab
Un ligand este un atom, un ion sau o moleculă care donează sau împarte doi dintre electronii săi printr-o legătură covalentă coordonată cu un atom sau ion central. Conceptul de liganzi este discutat în chimia coordonării. Liganzii sunt specii chimice care sunt implicate în formarea complecșilor cu ionii metalici. Prin urmare, sunt cunoscuți și ca agenți de complexare. Liganzii pot fi monodentati, bidentati, tridentati etc. in functie de denticitatea ligandului. Dentitatea este numărul de grupuri donatoare prezente într-un ligand. Monodentat înseamnă că ligand are un singur grup donor. Bidentat înseamnă că are două grupuri donatoare per o moleculă de ligand. Există două tipuri majore de liganzi clasificați pe baza teoriei câmpului cristalin; liganzi puternici (sau liganzi de câmp puternic) și liganzi slabi (sau liganzi de câmp slab). Diferența cheie dintre liganzii puternici și liganzii slabi este că divizarea orbitalilor după legarea la un ligand de câmp puternic determină o diferență mai mare între orbitalii de nivel de energie mai mare și cel mai scăzut, în timp ce divizarea orbitalilor după legarea la un ligand de câmp slab determină o diferență mai mică. între orbitalii de energie superior și inferior.
Ce este teoria câmpului de cristal?
Teoria câmpului cristalin poate fi descrisă ca un model care este conceput pentru a explica ruperea degenerescărilor (învelișuri de electroni de energie egală) a orbitalilor de electroni (de obicei orbitalii d sau f) din cauza câmpului electric static produs de un înconjurător. anion sau anioni (sau liganzi). Această teorie este adesea folosită pentru a demonstra comportamentul complecșilor de ioni de metale de tranziție. Această teorie poate explica proprietățile magnetice, culorile complexelor de coordonare, entalpiile de hidratare etc.
Teorie:
Interacțiunea dintre ionul metalic și liganzi este rezultatul atracției dintre ionul metalic cu sarcină pozitivă și sarcina negativă a electronilor neperechi ai ligandului. Această teorie se bazează în principal pe modificările care au loc în cinci orbitali de electroni degenerați (un atom de metal are cinci orbitali d). Când un ligand se apropie de ionul metalic, electronii nepereche sunt mai aproape de unii orbitali d decât cei ai altor orbitali d ai ionului de metal. Acest lucru provoacă o pierdere a degenerescenței. Și, de asemenea, electronii din orbitalii d resping electronii ligandului (deoarece ambii sunt încărcați negativ). Prin urmare, orbitalii d care sunt mai aproape de ligand au energie mare decât cea a altor orbitali d. Acest lucru are ca rezultat divizarea orbitalilor d în orbitali d de energie mare și orbitali d de energie joasă, pe baza energiei.
Unii factori care afectează această divizare sunt; natura ionului metalic, starea de oxidare a ionului metalic, aranjarea liganzilor în jurul ionului metalic central și natura liganzilor. După divizarea acestor orbitali d pe baza energiei, diferența dintre orbitalii d de energie în altă și joasă este cunoscută ca un parametru de divizare a câmpului cristalin (∆oct pentru complexele octaedrice).
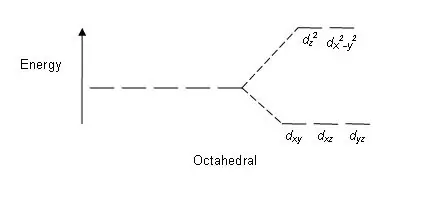
Figura 01: Model de împărțire în complexe octaedrice
Model de divizare: Deoarece există cinci orbitali d, divizarea are loc într-un raport de 2:3. În complexele octaedrice, doi orbitali sunt la nivelul de energie în alt (cunoscuți în mod colectiv sub denumirea de „de exemplu”), iar trei orbitali se află la nivelul energetic inferior (cunoscuți în mod colectiv ca t2g). În complexele tetraedrice se întâmplă invers; trei orbitali sunt la nivelul energetic superior și doi la nivelul energetic inferior.
Ce este un ligand puternic?
Un ligand puternic sau un ligand puternic de câmp este un ligand care poate duce la o divizare mai mare a câmpului cristalin. Aceasta înseamnă că legarea unui ligand puternic de câmp determină o diferență mai mare între orbitalii de nivel de energie superior și inferior. Exemplele includ CN- (liganzi de cianura), NO2- (ligand nitro) și CO (carbonil liganzi).
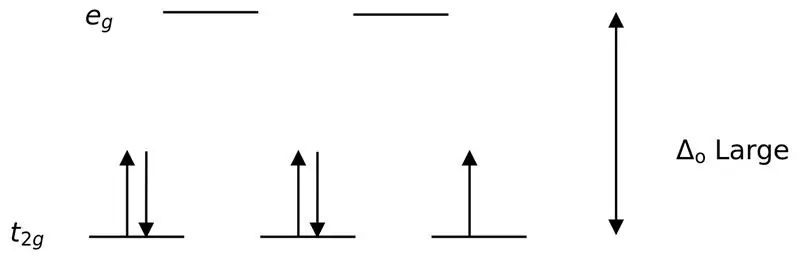
Figura 02: Divizarea învârtirii reduse
În formarea de complexe cu acești liganzi, la început, orbitalii de energie inferioară (t2g) sunt complet umpluți cu electroni înainte de a fi umpluți cu orice alți orbitali de nivel ridicat de energie (de exemplu). Complecșii formați în acest fel se numesc „complecși cu spin scăzut”.
Ce este ligand slab?
Un ligand slab sau un ligand cu câmp slab este un ligand care poate duce la o scindare mai mică a câmpului cristalin. Aceasta înseamnă că legarea unui ligand de câmp slab determină o diferență mai mică între orbitalii de nivel de energie superior și inferior.
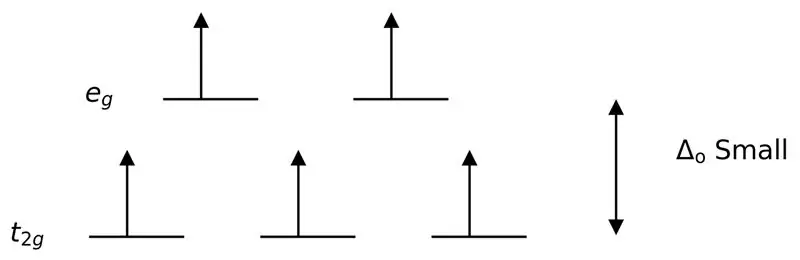
Figura 3: Divizarea învârtirii mari
În acest caz, deoarece diferența mică dintre cele două niveluri orbitale provoacă repulsii între electroni în acele niveluri de energie, orbitalii de energie mai mare pot fi umpluți cu ușurință cu electroni în comparație cu cei din orbitalii de energie joasă. Complecșii formați cu acești liganzi se numesc „complexe de spin în alt”. Exemple de liganzi de câmp slabi includ I- (ligand de iodură), Br- (ligand de bromură), etc.
Care este diferența dintre ligand puternic și ligand slab?
Ligand puternic vs Ligand slab |
|
| Un ligand puternic sau un ligand puternic de câmp este un ligand care poate duce la o divizare mai mare a câmpului cristalin. | Un ligand slab sau un ligand cu câmp slab este un ligand care poate duce la o scindare mai mică a câmpului cristalin. |
| Teoria | |
| Diviziunea după legarea unui ligand de câmp puternic determină o diferență mai mare între orbitalii de nivel de energie superior și inferior. | Divizarea orbitalilor după legarea unui ligand de câmp slab determină o diferență mai mică între orbitalii de nivel de energie mai mare și cel inferior. |
| Categoria | |
| Complecșii formați cu liganzi puternici de câmp se numesc „complecși cu spin scăzut”. | Complecșii formați cu liganzi de câmp slab se numesc „complecși cu spin în alt”. |
Rezumat - Ligand puternic vs Ligand slab
Liganzii puternici și liganzii slabi sunt anioni sau molecule care provoacă divizarea orbitalilor d ai unui ion metalic în două niveluri de energie. Diferența dintre liganzii puternici și liganzii slabi este că divizarea după legarea unui ligand de câmp puternic determină o diferență mai mare între orbitalii de nivel de energie superior și inferior, în timp ce scindarea orbitalilor după legarea unui ligand de câmp slab determină o diferență mai mică între orbitalii de nivel superior și inferior. orbitali de nivel de energie.






